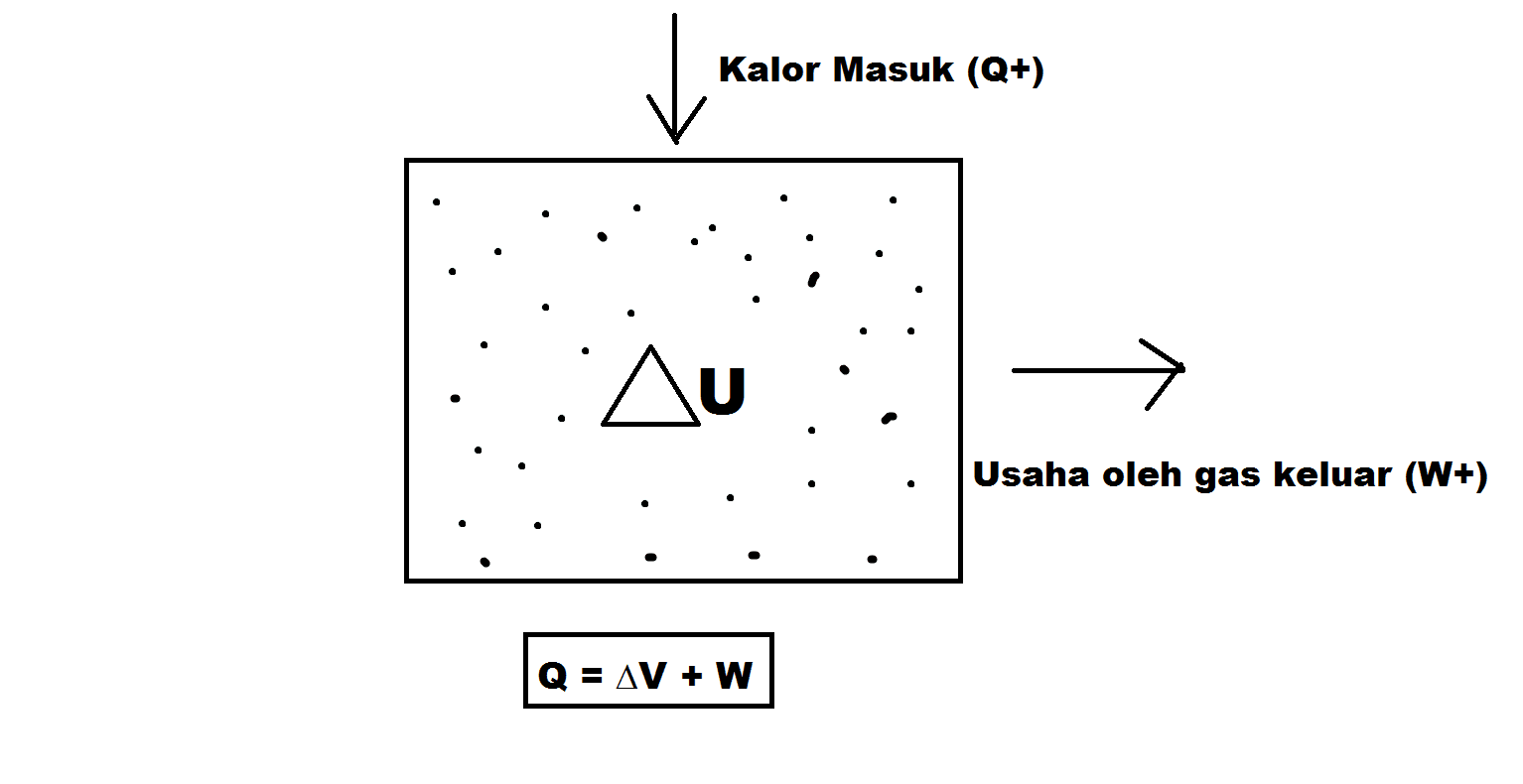
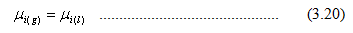Prinsip Ekuipartisi Energi
Pada subbab A, Anda telah mempelajari hubungan antara variabel-variabel yang menyatakan keadaan suatu gas dalam ruangan tertutup. Untuk mengamati keadaan gas tersebut, dapat dilakukan dengan dua cara, yaitu cara makroskopis dan mikroskopis. Jika Anda mengamati keadaan suatu gas dalam ruang tertutup berdasarkan besaran-besaran yang dapat dilihat atau diukur secara langsung, Anda dikatakan melakukan pengamatan secara makroskopis. Namun, jika pengamatan yang Anda lakukan berdasarkan pada variabel atau besaran yang tidak dapat dilihat atau diukur secara langsung, Anda dikatakan melakukan pengamatan secara mikroskopis.
Pengamatan keadaan gas secara makroskopis telah Anda lakukan dan pelajari pada subbab A. Pada subbab B ini, Anda akan mempelajari keadaan gas yang diamati secara mikroskopis serta hubungan antara besaran makroskopis dan besaran mikroskopis.