Hukum-Hukum tentang Gas
Teori kinetik gas membahas hubungan antara besaran-besaran yang menentukan keadaan suatu gas. Jika gas yang diamati berada di dalam ruangan tertutup, besaran-besaran yang menentukan keadaan gas tersebut adalah volume (V), tekanan (p), dan suhu gas (T). Menurut proses atau perlakuan yang diberikan pada gas, terdapat tiga jenis proses, yaitu isotermal, isobarik, dan isokhorik. Pembahasan mengenai setiap proses gas tersebut dapat Anda pelajari dalam uraian berikut.
a. Hukum Boyle
Perhatikanlah Gambar 1. berikut.
 |
| Gambar 1. (a) Gas di dalam tabung memiliki volume V1 dan tekanan P1. (b) Volume gas di dalam tabung diperbesar menjadi V2 sehingga tekanannya P2 menjadi lebih kecil. |
Suatu gas yang berada di dalam tabung dengan tutup yang dapat diturunkan atau dinaikkan, sedang diukur tekanannya. Dari gambar tersebut dapat Anda lihat bahwa saat tuas tutup tabung ditekan, volume gas akan mengecil dan mengakibatkan tekanan gas yang terukur oleh alat pengukur menjadi membesar. Hubungan antara tekanan (p) dan volume (V) suatu gas yang berada di ruang tertutup ini diteliti oleh Robert Boyle.
Saat melakukan percobaan tentang hubungan antara tekanan dan volume gas dalam suatu ruang tertutup, Robert Boyle menjaga agar tidak terjadi perubahan temperatur pada gas (isotermal). Dari data hasil pengamatannya, Boyle mendapatkan bahwa hasil kali antara tekanan (p) dan volume (V) gas pada suhu tetap adalah konstan. Hasil pengamatan Boyle tersebut kemudian dikenal sebagai Hukum Boyle yang secara matematis dinyatakan dengan persamaan :
pV = konstan (1–1)
atau
p1V1 = p2V2 (1–2)
Dalam bentuk grafik, hubungan antara tekanan (p) dan volume (V) dapat dilihat pada Gambar 2.
 |
| Gambar 2. Grafik p-V suatu gas pada dua suhu yang berbeda, di mana T1>T2. |
b. Hukum Gay-Lussac
Gay-Lussac, seorang ilmuwan asal Prancis, meneliti hubungan antara volume gas (V) dan temperatur (T) gas pada tekanan tetap (isobarik). Perhatikanlah Gambar 3.
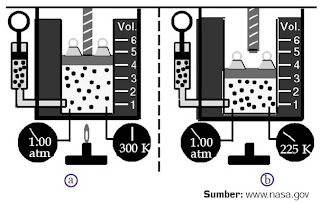 |
| Gambar 3. Pada tekanan 1 atm, (a) gas bervolume 4 m3 memiliki temperatur 300 K, sedangkan (b) gas bervolume 3 m3 memiliki temperatur 225 K. |
Misalnya, Anda memasukkan gas ideal ke dalam tabung yang memiliki tutup piston di atasnya. Pada keadaan awal, gas tersebut memiliki volume 4 m3 dan temperatur 300 K.
Jika kemudian pemanas gas tersebut dimatikan dan gas didinginkan hingga mencapai temperatur 225 K, volume gas itu menurun hingga 3 m3. Jika Anda membuat perbandingan antara volume terhadap suhu pada kedua keadaan gas tersebut (V/T) , Anda akan mendapatkan suatu nilai konstan (4/300 = 3/225 = 0,013).
Berdasarkan hasil penelitiannya mengenai hubungan antara volume dan temperatur gas pada tekanan tetap, Gay-Lussac menyatakan Hukum Gay-Lussac, yaitu hasil bagi antara volume (V) dengan temperatur (T) gas pada tekanan tetap adalah konstan.
Persamaan matematisnya dituliskan sebagai berikut.
 |
| Gambar 4. Grafik hubungan V–T. |
V/T = Konstan (1–3)
atau
V1/T1 = V2/T2 (1–4)
Tokoh Fisika :
Robert Boyle ialah seorang ilmuwan Fisika berkebangsaan Inggris. Melalui usaha dan kerja kerasnya, ia berhasil menemukan pompa vakum. Ia pun menemukan Hukum Boyle berdasarkan penelitian yang dilakukan dengan cermat dan teliti pada gas. Hukum Boyle banyak diterapkan dalam teknologi dan telah memberikan banyak manfaat dalam kehidupan manusia.
Agar Anda dapat lebih memahami Hukum Boyle dan Hukum Gay- Lussac, lakukanlah kegiatan Percobaan Fisika Sederhana 1 :
Robert Boyle
(1627–1691)
 |
| Gambar 5. Robert Boyle. [2] |
Agar Anda dapat lebih memahami Hukum Boyle dan Hukum Gay- Lussac, lakukanlah kegiatan Percobaan Fisika Sederhana 1 :
Percobaan Fisika Sederhana 1
Membuktikan Hukum Boyle dan Hukum Gay-Lussac
Alat dan Bahan :
- Bola tembaga dengan katup dan alat pengukur tekanan
- Alat pengisap
- Pembakar bunsen
- Gelas kimia
- Penyangga kaki tiga
- Termometer
- Beban dan jangka sorong
- Klem dan statip
Prosedur :
1. Susunlah alat-alat percobaan, seperti terlihat pada gambar.
2. Bukalah katup, kemudian tutuplah katup pada bola tembaga pada suhu kamar. Catatlah nilai tekanan gas di dalam bola tembaga yang ditunjukkan oleh alat pengukur tekanan. Catatlah kedua nilai besaran tersebut ke dalam tabel berikut.
No
|
Suhu (°C)
|
Tekanan (mmHg)
|
3. Benamkan bola tembaga ke dalam air es. Pastikan jumlah es yang terdapat di dalam gelas kimia cukup banyak sehingga dicapai suhu stabil sistem antara 0 –10° C. Pastikan juga bahwa bola tembaga tidak menyentuh dasar gelas kimia dan air es menutupi seluruh bola tembaga.
4. Masukkan termometer ke dalam gelas kimia (perhatikan agar termometer tidak menyentuh bola tembaga dan dasar gelas kimia).
5. Setelah temperatur stabil, catatlah nilai temperatur dan tekanan tersebut ke dalam tabel.
6. Nyalakanlah pembakar bunsen. Kemudian, catatlah nilai tekanan dan temperatur untuk setiap kenaikan tekanan yang ditunjukkan oleh alat pengukur tekanan.
7. Lakukanlah langkah ke-6 sampai air di dalam gelas kimia mendidih.
8. Bagaimanakah hubungan antara suhu dan tekanan yang Anda peroleh dari data pengamatan?
9. Sesuaikan hasil data pengamatan Anda dengan Hukum Gay-Lussac? Jika tidak sesuai, dapatkah Anda menjelaskan bagian apa yang menyebabkan timbulnya perbedaan tersebut? Diskusikanlah dengan teman-teman kelompok dan guru Fisika Anda.
B. Percobaan Boyle
1. Dalam percobaan Boyle ini, digunakan pompa yang memiliki katup yang dapat ditutup. Sejumlah gas yang telah ditentukan banyaknya, terperangkap di dalam pompa. Temperatur gas selalu sama dengan temperatur kamar, sedangkan tekanan gas diubah dengan cara menggantungkan beban yang berbeda-beda pada silinder pompa.
2. Bukalah katup di ujung pompa, kemudian aturlah pompa agar menunjukkan volume udara sebesar 9 cm3. Tutuplah katup pompa. Catatlah tekanan dan volume gas pada tabel berikut.
Massa (kg)
|
Gaya (N)
|
Tekanan (N/m2)
|
Volume (m3)
|
1/ Volume (1/m3)
|
0
|
0
|
0
|
9 × 10–6
|
1,11 × 105
|
0,2
| ||||
0,4
| ||||
...
|
Oleh karena tekanan gas yang diperhitungkan dalam percobaan ini adalah tekanan netto gas, Anda dapat menganggap tekanan udara luar pada keadaan awal gas adalah nol.
3. Tambahkan beban 200 g ke dalam pengisap. Bacalah volume gas dalam pengisap. Catatlah massa dan volume tersebut ke dalam tabel di atas.
4. Lakukanlah langkah k-3 hingga massa beban mencapai 1,6 kg.
5. Hitunglah tekanan di dalam pengisap dengan cara membagi gaya yang diberikan pada pengisap dengan luas penampang pengisap.
6. Ukurlah diameter pengisap menggunakan jangka sorong, kemudian hitunglah luas penampang pengisap tersebut.
7. Bagaimanakah hubungan antara tekanan dan volume pada percobaan tersebut?
8. Sesuaikah hasil data pengamatan Anda dengan Hukum Boyle?
c. Hukum Charles
Seorang ilmuwan Perancis lainnya, Charles, menyatakan hubungan antara tekanan (p) terhadap temperatur (T) suatu gas yang berada pada volume tetap (isokhorik). Hasil penelitiannya kemudian dikenal sebagai Hukum Charles yang menyatakan hasil bagi tekanan (p) dengan temperatur (T) suatu gas pada volume tetap adalah konstan.
Persamaan matematis dari Hukum Charles dinyatakan dengan :
 |
| Gambar 6. Grafik p-T suatu gas pada volume yang berbeda. |
P/T = Konstan (1–5)
atau
p1/T1 = p2/T2 (–6)
Anda dapat melakukan kegiatan Percobaan Fisika Sederhana 2 berikut secara berkelompok untuk lebih memahami Hukum Charles.
Percobaan Fisika Sederhana 2
Memahami Hukum Charles
Alat dan Bahan :
- Termometer
- Air
- Gelas kimia
- Pemanas
- Manometer
- Batang pengaduk
- Susunlah alat-alat dan bahan percobaan, seperti tampak pada gambar.
- Catatlah suhu awal dan perbedaan tinggi yang ditunjukkan manometer.
- Nyalakan pemanas, kemudian catatlah perbedaan tinggi raksa dalam kolom manometer setiap kenaikan suhu 5°C.
- Agar suhu air dalam gelas kimia merata, aduklah air tersebut dengan batang pengaduk.
- Diskusikan hubungan antara temperatur terhadap tekanan gas. Sesuaikah data hasil pengamatan Anda dengan Hukum Charles?
d. Persamaan Keadaan Gas Ideal
Pada proses isobarik, tekanan gas tetap, sedangkan volume dan temperatur gas berubah. Demikian juga dalam proses isokhorik dan isotermal, terdapat satu variabel atau besaran gas yang berada dalam keadaan tetap, sedangkan kedua variabel gas lainnya berubah. Bagaimanakah jika ketiga besaran yang menyatakan keadaan gas tersebut (tekanan, volume, dan suhu) berubah?
Dari ketiga hubungan antara tekanan, volume, dan suhu gas yang didapatkan dari Hukum Boyle dan Hukum Gay-Lussac dapat diturunkan suatu persamaan yang disebut persamaan keadaan gas ideal. Secara matematis, persamaan keadaan gas ideal dinyatakan dengan persamaan :
PV/T = Konstan (1–7)
atau
p1V1/T1 = p2V2/T2 (1–8)
Oleh karena setiap proses yang dilakukan pada gas berada dalam ruang tertutup, jumlah molekul gas yang terdapat di dalam ruang tersebut dapat ditentukan sebagai jumlah mol gas (n) yang jumlahnya selalu tetap. Anda tentu sudah mengetahui bahwa mol adalah suatu besaran yang digunakan untuk menyatakan massa suatu zat dalam gram yang besarnya sama dengan jumlah molekul zat tersebut. Dengan demikian, persamaan keadaan gas ideal dapat dituliskan menjadi :
pV/T = nR (1–9)
atau
pV = nRT (1–10)
dengan :
n = jumlah mol gas,
R = tetapan umum gas = 8,31 × 103 J/kmolK (SI) = 8,31 J/molK,
p = tekanan (N/m2),
V = volume (m3), dan
T = temperatur (K).
Dari definisi mol zat yang menyatakan bahwa :
jumlah mol = massa / massa relatif molekul
atau
n = m / Mr
Persamaan (1–10) dapat dituliskan menjadi :
pV = (m/Mr) RT (1–11)
Anda telah mempelajari bahwa massa jenis suatu zat adalah perbandingan antara massa dengan volume zat tersebut. Oleh karena itu, dari Persamaan (1–11) dapat diperoleh persamaan massa jenis gas :
ρ = m/V = p Mr/RT (1–12)
Menurut prinsip Avogadro, satu mol gas mengandung jumlah molekul gas yang sama. Jumlah molekul gas ini dinyatakan dengan bilangan Avogadro (NA) yang besarnya sama dengan 6,02 × 1023 molekul/mol. Dengan demikian, Persamaan (1–12) dapat dinyatakan menjadi :
pV = (N/NA) RT
atau
pV = N(R/NA) T (1–13)
dengan:
N = Banyak partikel gas, dan
NA = Bilangan avogadro = 6,02 × 1023 molekul/mol
Oleh karena nilai pada Persamaan (1–13) merupakan suatu nilai tetapan yang disebut konstanta Boltzmann, k, di mana k = 1,38 × 10-23 J/K maka persamaan keadaan gas ideal dapat juga dituliskan menjadi persamaan berikut.
pV = NkT (1–14)


Tidak ada komentar:
Posting Komentar