Kesetimbangan Uap – Cair dari Campuran Ideal Dua Komponen
Jika campuran dua cairan nyata (real) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing – masing komponen adalah sama dalam fasa gas dan cairnya.
dimana Po adalah tekanan standar (1 bar). Untuk fasa cair,
Persamaan 3.20 dapat ditulis menjadi
Dari persamaan 3.23 dapat disimpulkan bahwa
Persamaan 3.25 menyatakan bahwa bila uap merupakan gas ideal, maka aktifitas dari komponen i pada larutan adalah perbandingan tekanan parsial zat i di atas larutan (Pi ) dan tekanan uap murni dari zat i (Pio).
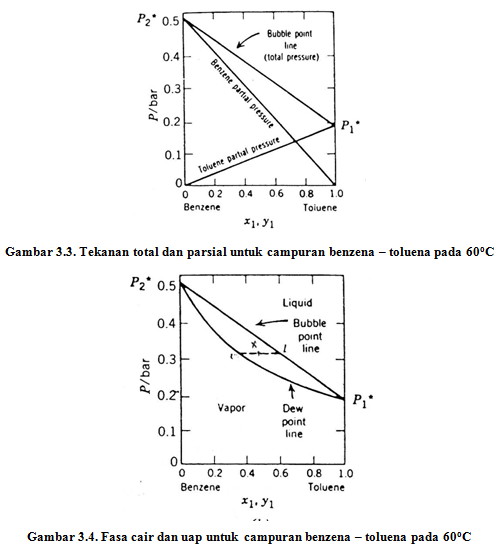
Pada tahun 1884, Raoult mengemukakan hubungan sederhana yang dapat digunakan untuk memperkirakan tekanan parsial zat i di atas larutan (Pi ) dari suatu komponen dalam larutan. Menurut Raoult,
Pernyataan ini disebut sebagai Hukum Raoult, yang akan dipenuhi bila komponen – komponen dalam larutan mempunyai sifat yang mirip atau antaraksi antar larutan besarnya sama dengan interaksi di dalam larutan (A – B = A – A = B – B). Campuran yang demikian disebut sebagai campuran ideal, contohnya campuran benzena dan toluena. Campuran ideal memiliki sifat – sifat
ΔHmix = 0
ΔVmix = 0
ΔSmix = – R Σni ln xi
Tekanan uap total di atas campuran adalah
Karena x2 = 1 – x1, maka
Persamaan di atas digunakan untuk membuat garis titik gelembung (bubble point line). Di atas garis ini, sistem berada dalam fasa cair. Komposisi uap pada kesetimbangan ditentukan dengan cara
Keadaan campuran ideal yang terdiri dari dua komponen dapat digambarkan dengan kurva tekanan tehadap fraksi mol berikut.
Gambar 3.3. Tekanan total dan parsial untuk campuran benzena – toluena pada 60oC
Gambar 3.4. Fasa cair dan uap untuk campuran benzena – toluena pada 60oC
Garis titik embun (dew point line) dibuat dengan menggunakan persamaan
Di bawah garis ini, sistem setimbang dalam keadaan uap.
Pada tekanan yang sama, titik – titik pada garis titik gelembung dan garis titik embun dihubungkan dengan garis horisontal yang disebut tie line (lihat gambar 3.4). Jika diandaikan fraksi mol toluena adalah x, maka jumlah zat yang berada dalam fasa cair adalah
Sedangkan jumlah zat yang berada dalam fas uap adalah
Penentuan jumlah zat pada kedua fasa dengan menggunakan persamaan 3.31 dan 3.32 disebut sebagai Lever Rule.
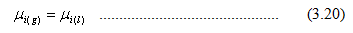
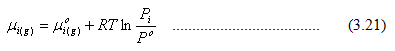
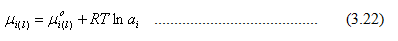
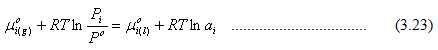

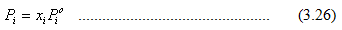
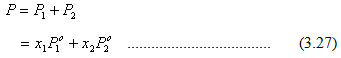
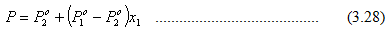
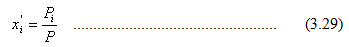
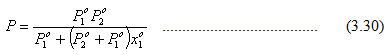
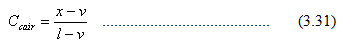
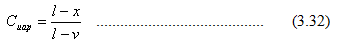
Tidak ada komentar:
Posting Komentar