Tekanan Uap Campuran Non Ideal
Tidak semua campuran bersifat ideal. Campuran – campuran non ideal ini mengalami penyimpangan / deviasi dari hukum Raoult. Terdapat dua macam penyimpangan hukum Raoult, yaitu
- Penyimpangan positif
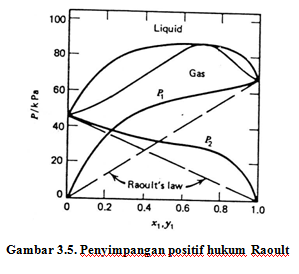
Penyimpangan positif hukum Raoult terjadi apabila interaksi dalam masing – masing zat lebih kuat daripada antaraksi dalam campuran zat ( A – A, B – B > A – B). Penyimpangan ini menghasilkan entalpi campuran (ΔHmix) positif (bersifat endotermik) dan mengakibatkan terjadinya penambahan volume campuran (ΔVmix > 0). Contoh penyimpangan positif terjadi pada campuran etanol dan n – hekasana.
Gambar 3.5. Penyimpangan positif hukum Raoult
- Penyimpangan negatif
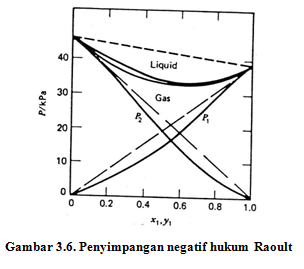
Penyimpangan negatif hukum Raoult terjadi apabila antaraksi dalam campuran zat lebih kuat daripada interaksi dalam masing – masing zat ( A – B > A – A, B – B). Penyimpangan ini menghasilkan entalpi campuran (ΔHmix) negatif (bersifat eksotermik) mengakibatkan terjadinya pengurangan volume campuran (ΔVmix < 0).. Contoh penyimpangan negatif terjadi pada campuran aseton dan air.
Gambar 3.6. Penyimpangan negatif hukum Raoult
Pada gambar 3.5 dan 3.6 terlihat bahwa masing – masing kurva memiliki tekanan uap maksimum dan minimum. Sistem yang memiliki nilai maksimum atau minimum disebut sistem azeotrop. Campuran azeotrop tidak dapat dipisahkan dengan menggunakan destilasi biasa. Pemisahan komponen 2 dan azotrop dapat dilakukan dengan destilasi bertingkat. Tetapi, komponen 1 tidak dapat diambil dari azeotrop. Komposisi azeotrop dapat dipecahkan dengan cara destilasi pada tekanan dimana campuran tidak membentuk sistem tersebut atau dengan menambahkan komponen ketiga.
Tidak ada komentar:
Posting Komentar